10/8/2021
トリメチルシリルエトキシカルボニル (Teoc) は、Cbz、Boc、Fmoc、および Alloc とは異なります。 酸、ほとんどのアルカリ、および貴金属触媒に対して非常に安定です。 存在下でCbz、Boc、Fmoc、Allocなどを選択的に脱保護することができ、その除去は通常フッ化物アニオン中で行われます。
トリメチルシリルエトキシカルボニル(Teoc)保護基の応用
構造式:

トリメチルシリルエトキシカルボニル(Teoc)の導入メカニズム:
Teoc 保護基の導入は、Teoc-Osu を例にとります。そのメカニズムは次のとおりです。

トリメチルシリルエトキシカルボニル(Teoc)の除去メカニズム:

トリメチルシリルエトキシカルボニル(Teoc)の用途:
近年、活性官能基を保護するためのシリコンベースの試薬の使用が急速に発展しており、トリメチルシリルエトキシカルボニル(Teoc)は有機合成および生化学におけるアミノ基の保護剤として最も多く使用されています。トリメチルシリルエトキシカルボニル(Teoc)は、Cbz、Boc、Fmoc、Allocとは異なり、酸、ほとんどのアルカリ、および貴金属触媒に対して非常に安定しています。その存在下では、Cbz、Boc、Fmoc、Allocなどを選択的に脱保護することができ、その除去は通常、TBAF、TEAF、HFなどのフッ化物アニオンで行われます。あるいは、TFAはトリメチルシリルエトキシカルボニル基を選択的に脱保護することもできます。
応用1: 従来のアミノ基の保護
Teoc 保護基は通常、Teoc-Cl、Teoc-NT、Teoc-OSu、または Teoc-OBt を使用して、塩基の存在下でアミノ化合物と反応します。塩基は有機塩基、ピリジン、トリエチルアミン、または無機塩基、重炭酸ナトリウムのいずれかで、これにより Teoc 保護アミノ誘導体が得られます。
カルバメート保護アミノ基の研究では、Teoc保護基の反応安定性が高く、保護試薬は水分を吸収しにくいため、反応にさらされても問題がなく、Teoc-NTを使用して生成されたニトロイミダゾールもリサイクル可能であるとMamoru氏は説明しました。高純度のTeoc試薬を使用すると、面倒なカラムクロマトグラフィー精製なしで、より純度の高いアミノ誘導体が得られる場合があります。
例1: Teoc-OBt/トリエチルアミン系収率92%

例2: Teoc-Cl/重炭酸ナトリウム系、収率87%

例3: Teoc-Osu/トリエチルアミン系収率95%

例4: Teoc-NT/トリエチルアミン系収率98%

応用2: ヌクレオシド誘導体のアミノ保護
Teoc 保護基の導入は比較的クリーンで扱いやすいため、ヌクレオチド保護にもよく使用されます。たとえば、シチジン誘導体は、下図に示すように、塩基なしで Teoc 基を導入できます。

同様に、アデノシン誘導体 14A の 6-NH2 も、中性条件下で Teoc 基を選択的に導入するのに非常に効果的です。しかし、グアノシン誘導体のアミノ基の反応は塩基なしでは実行が難しく、トリエチルアミンが必要です。塩基として、Teoc-Cl が導入剤であり、下図に示されています。

Teoc 基はヌクレオシド誘導体に広く使用されていますが、2,2'-デオキシグアノシン誘導体の 2-NH2 への Teoc 基の導入は成功していないことが報告されています。
応用3: アミノ酸誘導体のアミノ保護
アミノ酸誘導体の多様性により、そのアミノ基を保護することもより重要になります。さまざまな保護基がさまざまなニーズに応じて選択されますが、Teoc 保護基もよく選択されます。
アミノ酸誘導体の Teoc 保護に関するリチャードの実験表:
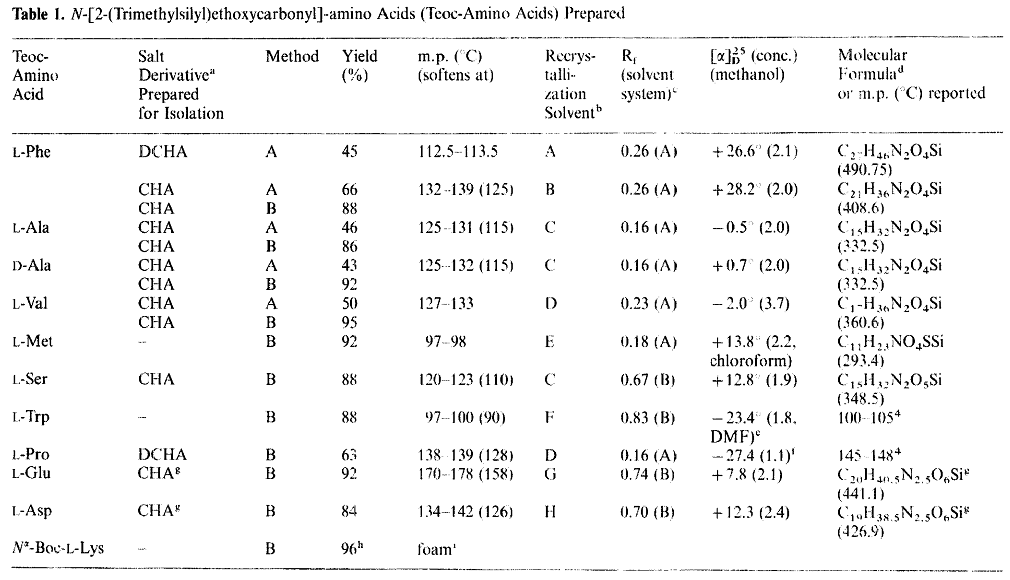
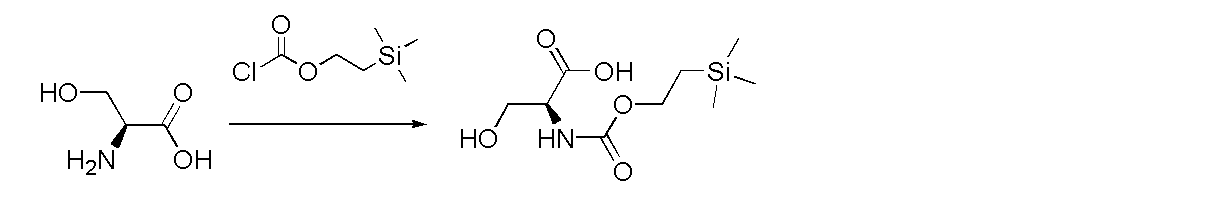
L-セリンは、下図に示すように、塩基としてトリエチルアミンを使用し、導入剤として Teoc-Cl を使用します。
L-グルタミン酸のTeoc保護は次のとおりです。

上記の報告から、Teoc 保護基はアミノ酸保護に高い適用性があることがわかります。
実験操作:
インスタンス 1 の保護:
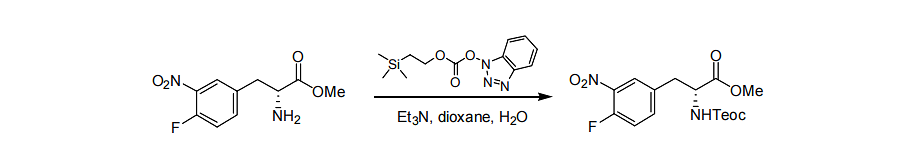
出発原料(3.0 g、12.4 mmol、1.0)をジクロロメタン(50 mL)に加え、続いてトリエチルアミン(3.25 g、32.2 mmol、2.6)を加えた。次に、Teoc-OBt(3.52 g、13.63 mmol、1.1)を加え、原料が完全に消費されるまで20〜25℃で温度を制御します。反応物に飽和硫酸水素カリウム溶液20mLを加え、有機相を分離して飽和塩水20mLで洗浄し、有機相を無水硫酸マグネシウムで乾燥させ、濾過し、濃縮して、4.4gの生成物を92%の収率で得た。
例2 脱保護:

原料(5.5g、18.68mmol、1.0)をテトラヒドロフラン(70)に加え、テトラブチルアンモニウムフルオリド(7.33g、28.02mmol、1.5)をバッチで添加し、原料が完全に消費されるまで室温で反応させた。反応溶液を濃縮してテトラヒドロフランを除去し、カラムクロマトグラフィーにより粗生成物を得て、収率は85%であった。
参考文献:
[1] ボーガー、デール L;キム、センホンら、J.Am.化学。協会、2001、123(9)、1862-1871;
[2]シュート、リチャード;リッチ、ダニエルH;シンセシス、1987、4、346-349
[3] 清水守、袖岡美紀子、ORGANIC LETTERS、2007年、第9巻、第25号、5231-5234
[4]Seng Heonら、J.Am.化学。学会、2000、122(30)、7416-7417
[5] グギウ、ボグダン G。サロモン、ロバート G;組織レター、2003、5(16)、2797-2800
[6]ティウス、マーカスA;トゥルカウフ、アンドリュー。 Tetrahedron Lett.、1986、27(38)、4541-4544
ご興味のある関連商品をご紹介いたします。ご不明な点がございましたら、お気軽にお問い合わせください。
ペプチド合成試薬のお見積もりは下記のフォームにご記入ください。